
Gennaio è quasi terminato e ormai febbraio è alle porte: le tre leggi fondamentali della chimica sono state enunciate, la conseguente teoria atomica di Dalton è già alle spalle, gli atomi sono “indivisibili”, e adesso? È arrivato il momento di spiegare agli studenti com’è fatto un atomo al suo interno, prima di affrontare la configurazione elettronica.
Spesso in classe, per introdurre nuovi argomenti, è utile partire dalla loro evoluzione storica, ossia si cerca di far capire come nel corso degli anni (o meglio, dei secoli) si è arrivati a elaborare le attuali teorie. Il caso più eclatante di quest’approccio “storico” è senza dubbio quello della teoria atomica.
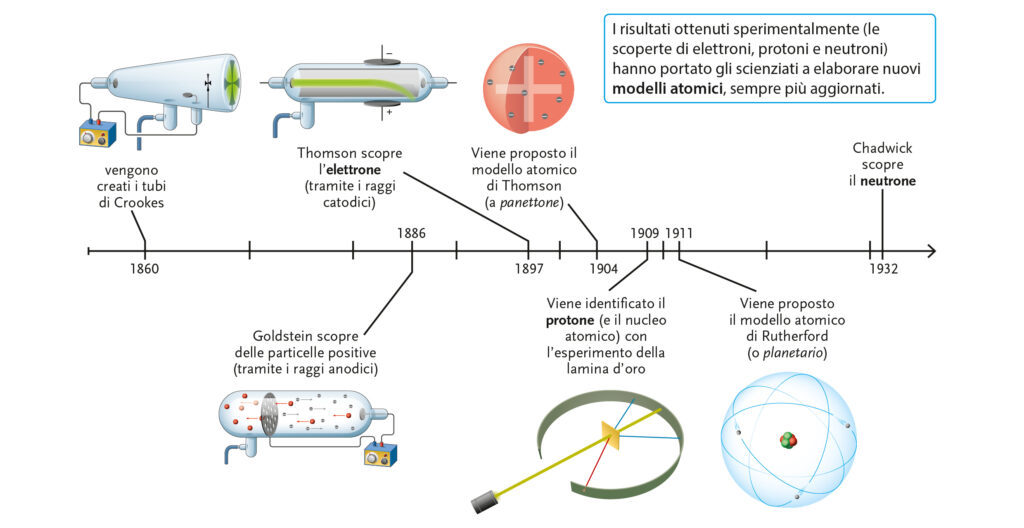
Una prima immagine da proiettare (vedi anche slide #2 del PowerPoint in allegato) può essere una linea del tempo in cui va messa in risalto la correlazione tra esperimenti scientifici (tubi di Crookes, raggi catodici e anodici, esperimento della lamina d’oro) e la scoperta delle particelle negative (elettroni) e positive (protoni). Queste scoperte portano poi alla formulazione di teorie atomiche (Thomson prima e Rutherford poi) che, se non confermate, vengono aggiornate e migliorate, come prevede il metodo scientifico.
Approfondendo poi il discorso sui raggi anodici (slide #3) e i successivi esperimenti con mulinello, croce di Malta e campi elettrici (slide #4) si arriva all’identificazione di particelle negative, chiamate elettroni, che hanno portato al primo modello atomico vero e proprio ad opera di Thomson, detto modello a panettone (slide #5) per la sua doppia analogia: pan di spagna = carica positiva ben distribuita e canditi = elettroni.
Passando alle particelle positive, in principio scoperte da Goldstein con i raggi anodici (slide #6), la buona comprensione dell’esperimento di Rutherford (facilitato dallo schema presente nella silde #7 e dal video qui sotto) è fondamentale per introdurre il concetto di nucleo. Concetto che porta al superamento del modello di Thomson e alla proposta del nuovo modello di Rutherford (slide #8) che ha avuto il gran merito di collocare nel nucleo le cariche positive e all’esterno di esso quelle negative, cosa tutt’ora accettata.
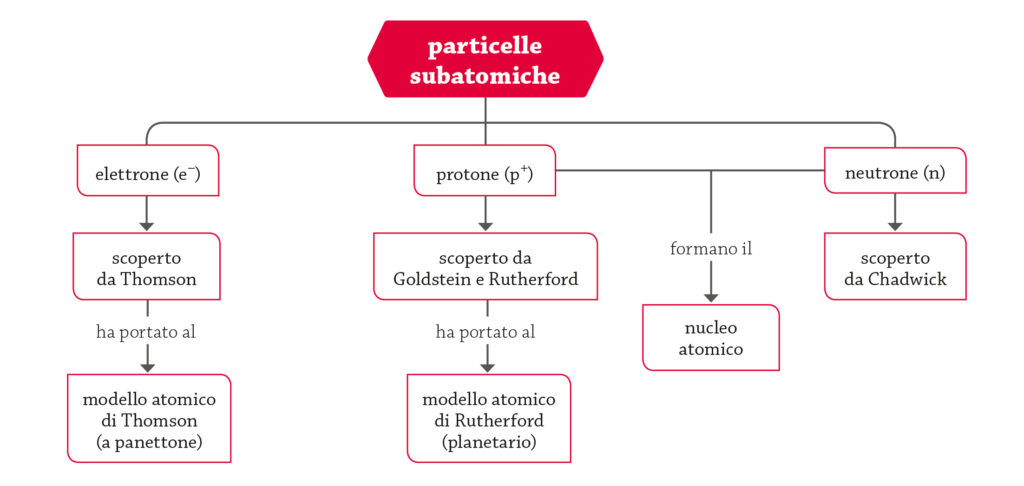
A questo punto, prima di andare avanti, è utile fermarsi un attimo e ricapitolare i concetti fin qui espressi con una piccola mappa concettuale (vedi slide #9).
Ma gli atomi dello stesso elemento sono tutti uguali tra loro come enunciato da Dalton? In realtà ci possono essere più atomi con lo stesso numero di protoni ma con diverso numero di neutroni, detti isotopi (caso dei tre isotopi dell’H, slide #10). Grazie a quest’esempio si introducono numero atomico, numero di massa e simbologia degli isotopi (vedi figura e slide #11), sottolineando il fatto che sulla tavola periodica NON si trovano i numeri di massa dei vari isotopi ma solo i numeri atomici, che identificano l’elemento (slide #12).
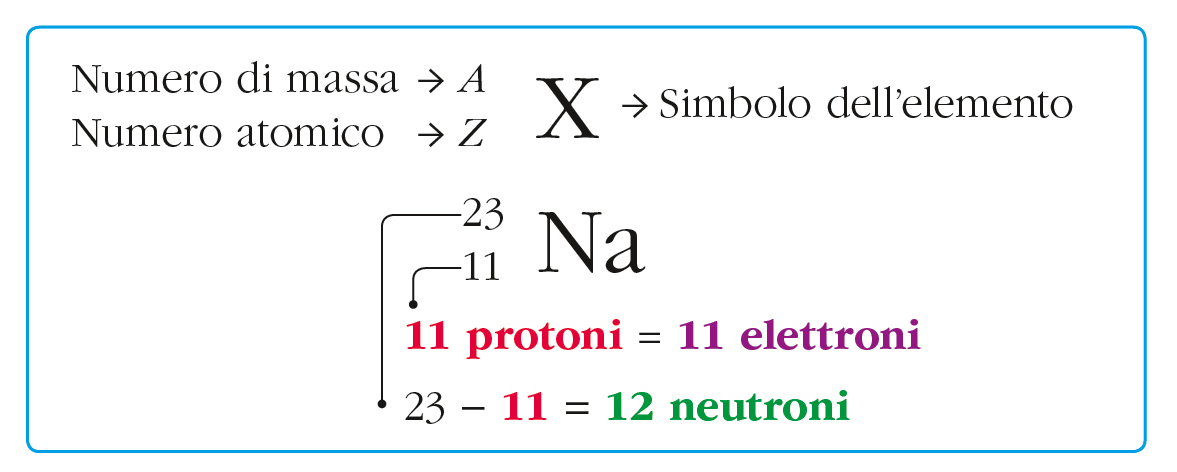
A questo proposito, per evitare fraintendimenti, l’ideale sarebbe avere un libro con una tavola periodica che posizioni il numero atomico in basso a sinistra (slide #13), come appena evidenziato nella simbologia.
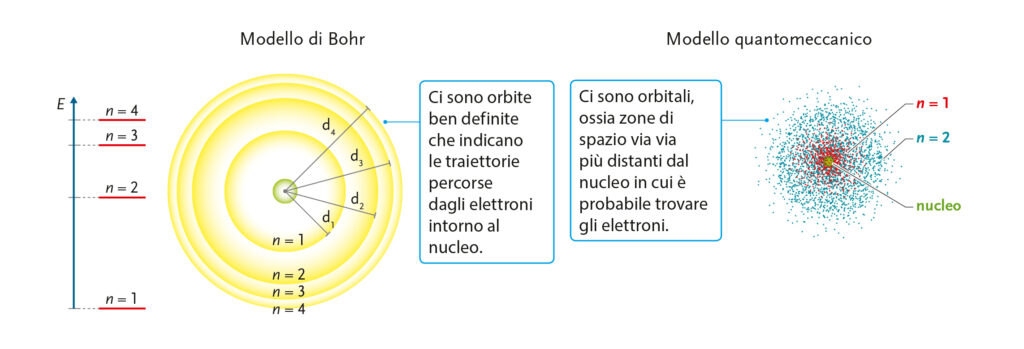
Per riprendere il percorso evolutivo dei modelli atomici può essere utile a questo punto evidenziare i problemi del modello di Rutherford, uno dei quali è sicuramente la mancata attrazione verso il nucleo degli elettroni a opera dei neutroni. Proprio per superare questo problema, Bohr teorizza un modello con orbite quantizzate, ossia particolari posizioni in cui gli elettroni possono ruotare attorno al nucleo senza ricadervi dentro (slide #14). La quantizzazione dell’energia viene spiegata poi con l’assorbimento e la successiva emissione di una particolare quantità di energia da parte di un elettrone che salta da un’orbita a quella successiva (per poi ritornare sull’orbita iniziale, slide #15).
Tuttavia anche il modello di Bohr viene superato dal modello-quantomeccanico. Il concetto di orbita viene sostituito da quello di orbitale, ossia la regione di spazio intorno al nucleo dove è massima la probabilità di trovare l’elettrone. Si parla di funzione d’onda ed equazione di Schroedingher, tutti concetti molto astratti e complicati per ragazzi del primo anno che, tuttavia, possono risultare un po’ più semplici se accompagnati da immagini e schematizzazioni (vedi slide #16 e #17).
Per finire è utile effettuare un ripasso di tutti i modelli atomici, per apprezzarne ancora di più la loro evoluzione nel tempo (slide #18) e successivamente applicare i concetti appresi sulla quantizzazione dell’energia con un’esperienza di laboratorio, i saggi alla fiamma (slide #19).


Utilizza direttamente la presentazione in classe con i tuoi studenti.
L’esperienza completa e tutte le immagini e gli schemi utilizzati sono presenti sui libri Connecting Science (Deascuola, 2019) per il primo e secondo biennio dei licei scientifici e sul nuovissimo Chimica OK (Deascuola, 2020), per il primo biennio degli istituti tecnici.
