

Un’esperienza comune per i docenti è l’espressione smarrita dei propri studenti, in classe o in DAD, quando si desiderano introdurre i concetti basilari di termochimica, agganciandoli brevemente alla termodinamica.
Spesso sono i termini poco utilizzati a disorientare e a mettere sulla difensiva gli studenti.
Dimostriamo allora con un semplice vissuto di tutti i giorni che la termodinamica non è teoria fine a se stessa, ma è vicina alla nostra quotidianità e ci aiuta a risolvere problemi pratici più o meno semplici.
Partiamo allora dalla proposta di un video che spiega i diversi modi con cui si può aprire un barattolo di vetro chiuso con un tappo metallico sotto pressione.
Soffermiamoci su due fotogrammi in particolare:
- Il barattolo investito dal soffio caldo di un phon per capelli
- Il barattolo immerso capovolto in una bacinella con acqua calda
Chiediamo ai ragazzi una possibile correlazione tra i due frame.
Sarà intuitivo per loro mettere subito in evidenza l’importanza del calore che si trasferisce dall’aria o dall’acqua al tappo metallico. Il gioco è fatto.
Da qui infatti possiamo seguire il percorso tradizionale che riassume il principio zero della termodinamica cioè la spontaneità con cui il calore passa da un corpo a temperatura maggiore verso un altro a temperatura minore.
Questo principio pone l’accento sulla variabile fondamentale della termodinamica: la temperatura.
Cosa serve allora per poter osservare un aumento di temperatura in un oggetto?
E’ necessario un trasferimento di energia sotto forma di calore oppure ………l’applicazione di una forza ed il suo spostamento, cioè un lavoro.
Non è un caso allora che calore e lavoro vengano espressi dalla stessa unità di misura: nel SI è il joule (J), pari ad 1 kg m2 s −2 (1 N m), perché calore e lavoro sono forme interscambiabili di energia, come è dimostrato dalle esperienze di Joule
È possibile approfondire l’argomento con un video sul Primo Principio della Termodinamica ( Connecting Science – Chimica Plus – II biennio)
Già, ma torniamo al tappo.
Perché si riesce a svitare facilmente dopo aver ricevuto calore dal phon o dall’acqua calda? Il tappo di metallo, come la maggior parte dei corpi, modifica, se riscaldato, alcune proprietà (come colore, conduzione elettrica, dilatazione volumetrica): in particolare la sua dilatazione impedisce di aderire perfettamente al collo del barattolo così che, entrando aria dall’esterno, sarà eguagliata la pressione all’interno del contenitore di vetro e voilà il tappo non offre più resistenza: il barattolo si apre all’istante.

Il nostro barattolo si può considerare come un sistema fisico che è definito da parametri macroscopici come volume, pressione e temperatura, le variabili termodinamiche; quindi il barattolo è un sistema termodinamico, da non confondere con l’ambiente che è tutto ciò che è posto al di fuori del sistema.
Un sistema termodinamico può scambiare materia ed energia con l’ambiente, in base al tipo di scambio o all’assenza di qualsiasi interazione con l’ambiente; è definito per questo aperto, chiuso o isolato.
A tale proposito si può chiedere agli studenti di fornire una definizione per i tre casi commentando un’immagine come la seguente e quindi di applicare la definizione stabilita al nostro barattolo di vetro: è un sistema termodinamico aperto, chiuso o isolato? In quale condizione si può considerare chiuso?
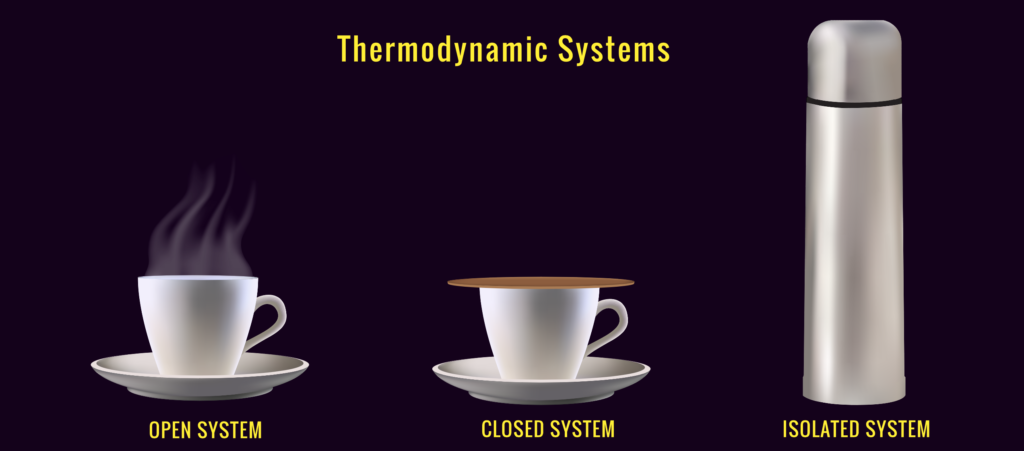
Siamo pronti per introdurre un altro concetto.
Ogni sistema possiede una quantità totale di energia, rappresentata dalla propria energia interna U che si può considerare a due livelli:
- a livello macroscopico U corrisponde alla somma di calore e lavoro che la termodinamica studia attraverso i possibili passaggi di energia tra i sistemi e l’ambiente.
- a livello microscopico rappresenta l’insieme di energia cinetica e potenziale che appartiene a tutti gli atomi e alle molecole del sistema termodinamico e che la termochimica, settore della termodinamica, mette in evidenza attraverso le variazioni di energia presenti durante le trasformazioni chimiche tra reagenti e prodotti. Esse sono causate dalle variazioni del moto di atomi e molecole e dal loro riassetto elettronico dovuto alla formazione di nuovi legami necessari per la trasformazione da reagenti a prodotti. Anche queste forme di energia sono tra loro interconvertibili.
U = E cinetica + E potenziale
Per comprendere meglio il significato microscopico dell’energia interna, considera lo schema seguente (da Connecting Science – Chimica Plus – II biennio)
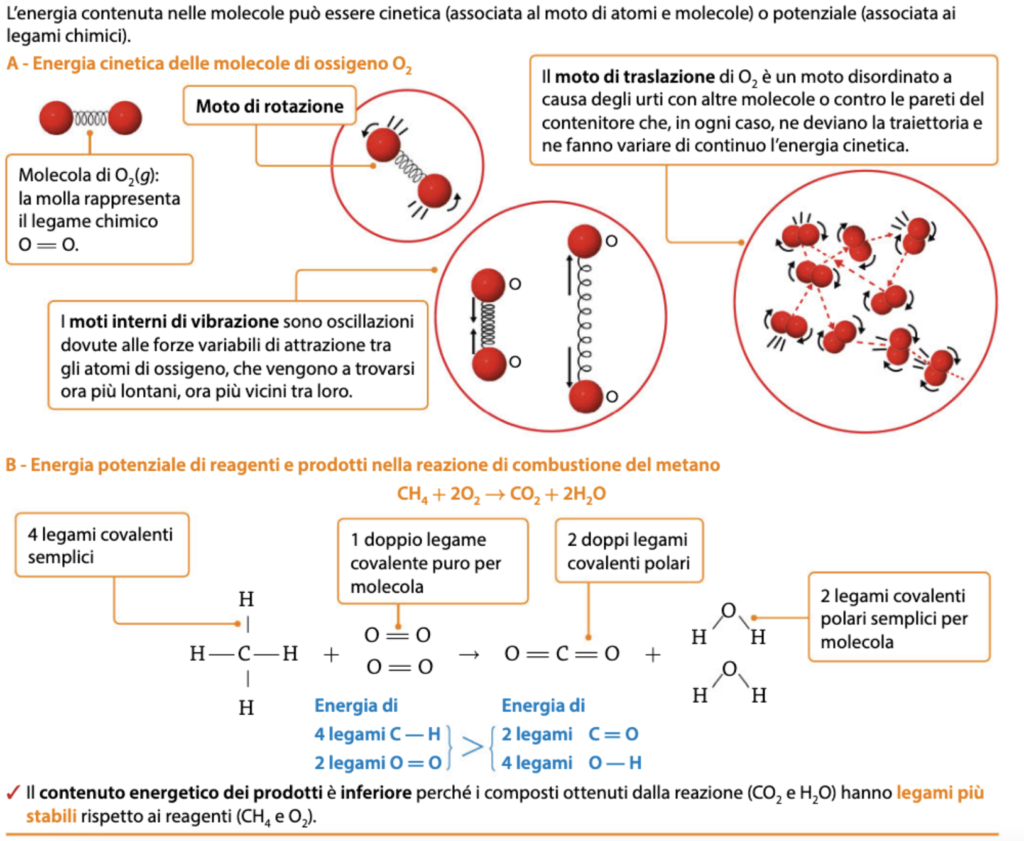
Il tappo del nostro barattolo possiede una energia interna U che si può descrivere a livello macroscopico con i parametri di temperatura e volume; a livello microscopico si può considerare un aumento dell’energia cinetica a seguito del trasferimento di calore, ma l’assetto elettronico, caratterizzato da legame metallico, non subisce trasformazioni. Il materiale dei tappi metallici è costituito da leghe di zinco, alluminio e acciaio, spesso ricoperti parzialmente con altri materiali soprattutto sul lato a contatto con gli alimenti.
Una curiosità: il brevetto del primo barattolo in vetro con un tappo di zinco è datato 1858.
In termochimica si esprime con calore di reazione (Q) la quantità di calore ceduta o acquistata nei confronti dell’ambiente nel corso di una reazione di combustione, di formazione e di neutralizzazione. A questo proposito si possono distinguere reazioni esotermiche ed endotermiche.
Nelle reazioni chimiche che avvengono, a pressione costante, in sistemi termodinamici chiusi, il calore di reazione Q corrisponde esattamente alle variazioni di una particolare grandezza termodinamica: l’entalpia (H), espressione sia di U, energia interna, che del lavoro svolto dal sistema. L’entalpia è l’espressione dell’energia totale posseduta dal sistema e viene espressa di conseguenza sempre in joule.
Le variazioni di entalpia, ΔH, di un sistema chimico si calcolano così:
ΔH = H prodotti – H reagent
Utilizziamo le prossime due schede affiancate per associare meglio la differenza tra reazioni esotermiche ed endotermiche, anche rispetto alla variazione di entalpia (da Connecting Science – Chimica Plus – II biennio)
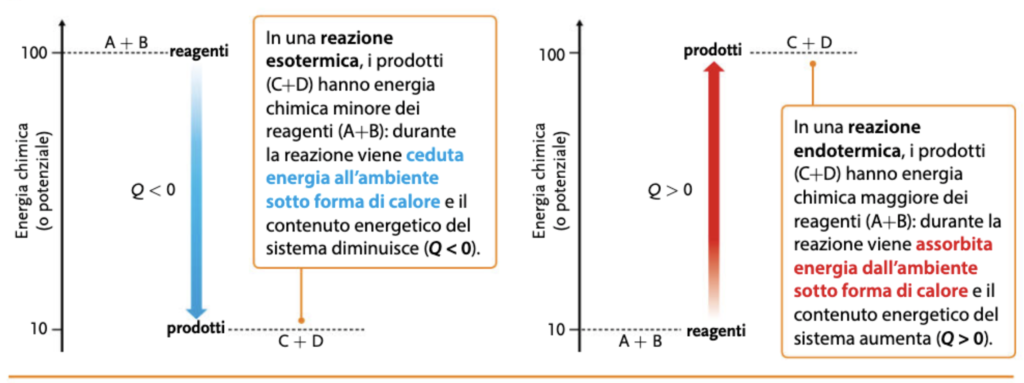
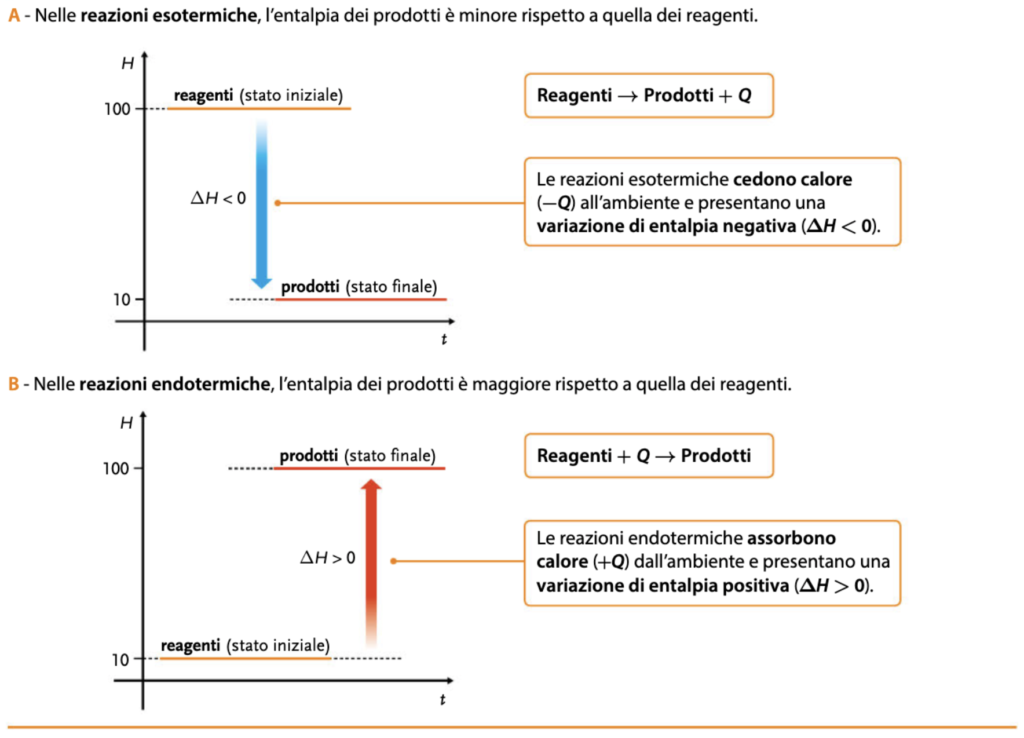
Il discorso sulla termodinamica non è certo concluso, ma abbiamo per così dire rotto il ghiaccio con un argomento spesso accantonato dagli studenti come “difficile”, ancor prima di accostarlo.
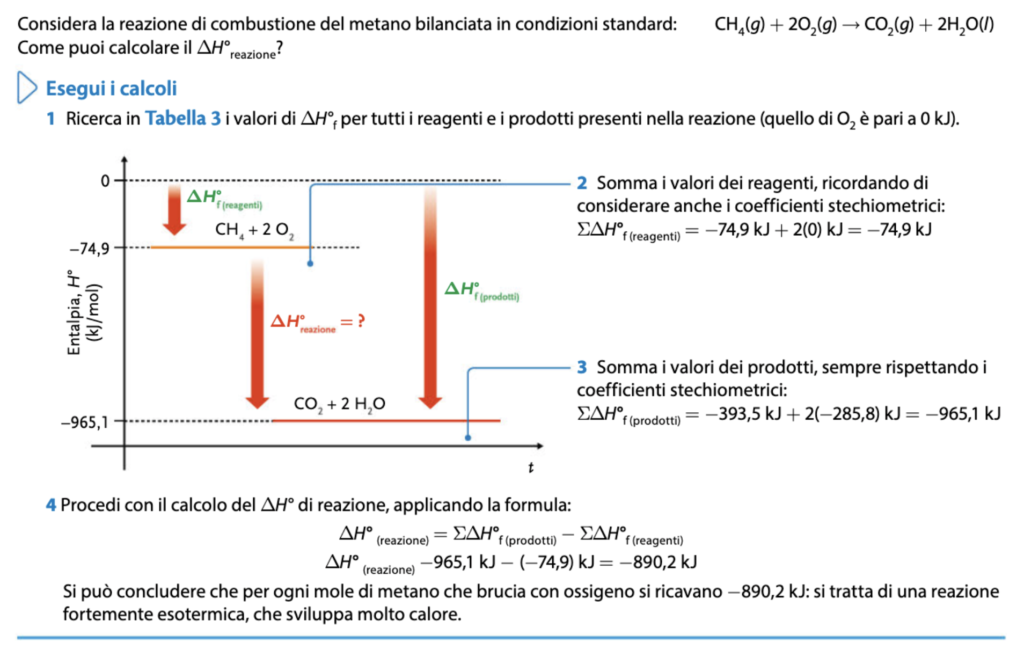
Come rinforzo dei concetti appena introdotti, si può richiedere agli studenti di preparare 4 diapositive riassuntive da condividere e discutere insieme, oppure commentare un esercizio svolto per il calcolo della differenza di entalpia della reazione di combustione del metano (come in figura, da Connecting Science – Chimica Plus – II biennio)
Un’ulteriore proposta applicativa, che assolve anche alla funzione CLIL, riguarda la proposta degli approfondimenti sull’energia interna in lingua inglese presenti ai seguenti link, i primi due in forma sono video, il terzo è un testo.
- https://www.khanacademy.org/science/chemistry/thermodynamics-chemistry/internal-energy-sal/v/more-on-internal-energy?modal=1
- https://www.khanacademy.org/science/chemistry/thermodynamics-chemistry/internal-energy-sal/v/calculating-internal-energy-and-work-example?modal=1
- https://www.khanacademy.org/science/chemistry/thermodynamics-chemistry/internal-energy-sal/a/heat?modal=1
