
Spesso, quando un insegnante affronta durante l’anno scolastico il concetto di mole, il primo ostacolo che si trova davanti è quello di far comprendere alla classe il suo significato e le sue applicazioni in chimica.
Non è certo semplice condurre gli studenti all’acquisizione di una nozione fondamentale per la chimica quantitativa come quella di mole, proprio in ragione delle difficoltà intrinseche che essa ha e che sono ben rappresentate dalla storia complessa e travagliata della sua elaborazione.
Ma è davvero un argomento così ostico per uno studente?
Io non sono d’accordo e, come provo a mostrare in questo articolo e attraverso il video proposto, spero di convincervi che effettivamente non lo è.
La mole: il suo significato oltre le definizioni
Partiamo dalla definizione di mole. Secondo il Sistema Internazionale in vigore fino al 2019, la mole era
“la quantità di sostanza di un sistema che contiene tante entità elementari quanti sono gli atomi contenuti in 0,012 kg di 12C”.
Oggi viene invece indicata come:
“la quantità di sostanza di un sistema che contiene un numero di unità elementari pari alla costante di Avogadro (6,022·1023 mol-1)”.
La verità è che, se ci limitassimo a leggere queste definizioni, uno studente che si imbatte per la prima volta nel concetto di mole, non potrà mai capirne il suo significato profondo e apprezzarne la sua “bellezza”.
I chimici, come si sa, si distinguono proprio in due grosse categorie: chi ha imparato a memoria formule e definizioni perché era obbligato a fare gli esercizi e chi, invece, ha compreso davvero che cos’è la mole e soprattutto perché è stata inventata.
Guardare a questa seconda categoria diventa essenziale nel dare all’argomento un’impostazione didattica che permetta a tutti i docenti di far ragionare i loro studenti come dei “veri” chimici, arrivando, perché no, a farli “innamorare” della mole.
Come introdurre alla classe la mole
Cominciamo la nostra spiegazione facendo delle domande dirette ai ragazzi. Per esempio: qual è la massa di un atomo di sodio? Posso pesarlo su una bilancia da laboratorio? E una molecola d’acqua che massa ha in grammi?
Per rispondere a queste domande potrebbe essere utile partire dalle seguenti rappresentazioni che mostrano il passaggio da un livello submicroscopico a un livello macroscopico di una molecola d’acqua.
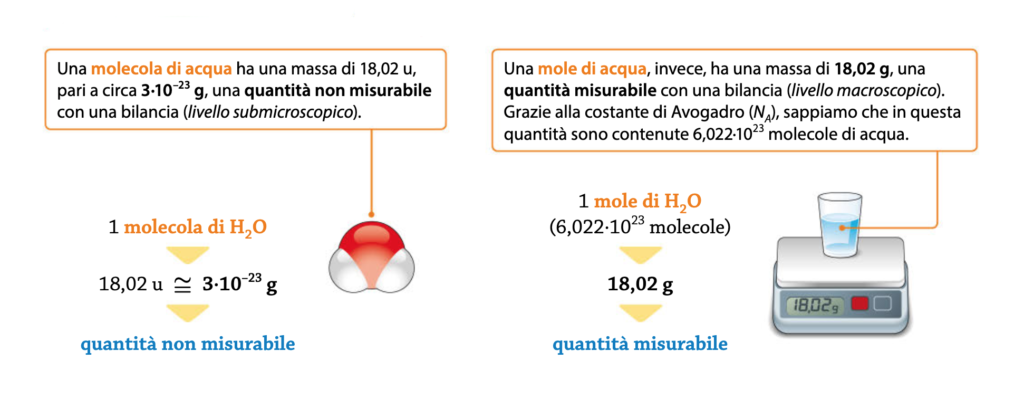
Le immagini ci permettono di distinguere tra mondo macroscopico e mondo “submicroscopico”: osservandole attentamente riusciamo a far comprendere come una molecola di una sostanza sia troppo piccola da pesare (siamo nell’ordine dei 10-23 g per una molecola di acqua). Però, se ne prendiamo un numero enorme (6,022·1023, costante di Avogadro) allora sì che la bilancia riesce a rilevarne la quantità.
Il concetto probabilmente non è ancora chiaro alla classe, ma siamo solo all’inizio. A questo punto si potrebbe far vedere la prima parte del filmato proposto, di cui sono riportati, più sotto, due screenshot. Vi invito a vedere il video fino al minuto 1:40, prima di proseguire con la lettura dell’articolo.
Come si può vedere, il punto di partenza è una domanda: è possibile pesare un atomo di sodio con una bilancia da laboratorio? Essendo la risposta negativa, si adopera una bilancia “virtuale” (immaginaria) che fa capire come, aggiungendo atomo dopo atomo (vedi contatore), sia impossibile andare a misurarne la loro massa, a meno che non si raggiungano dei numeri elevatissimi.
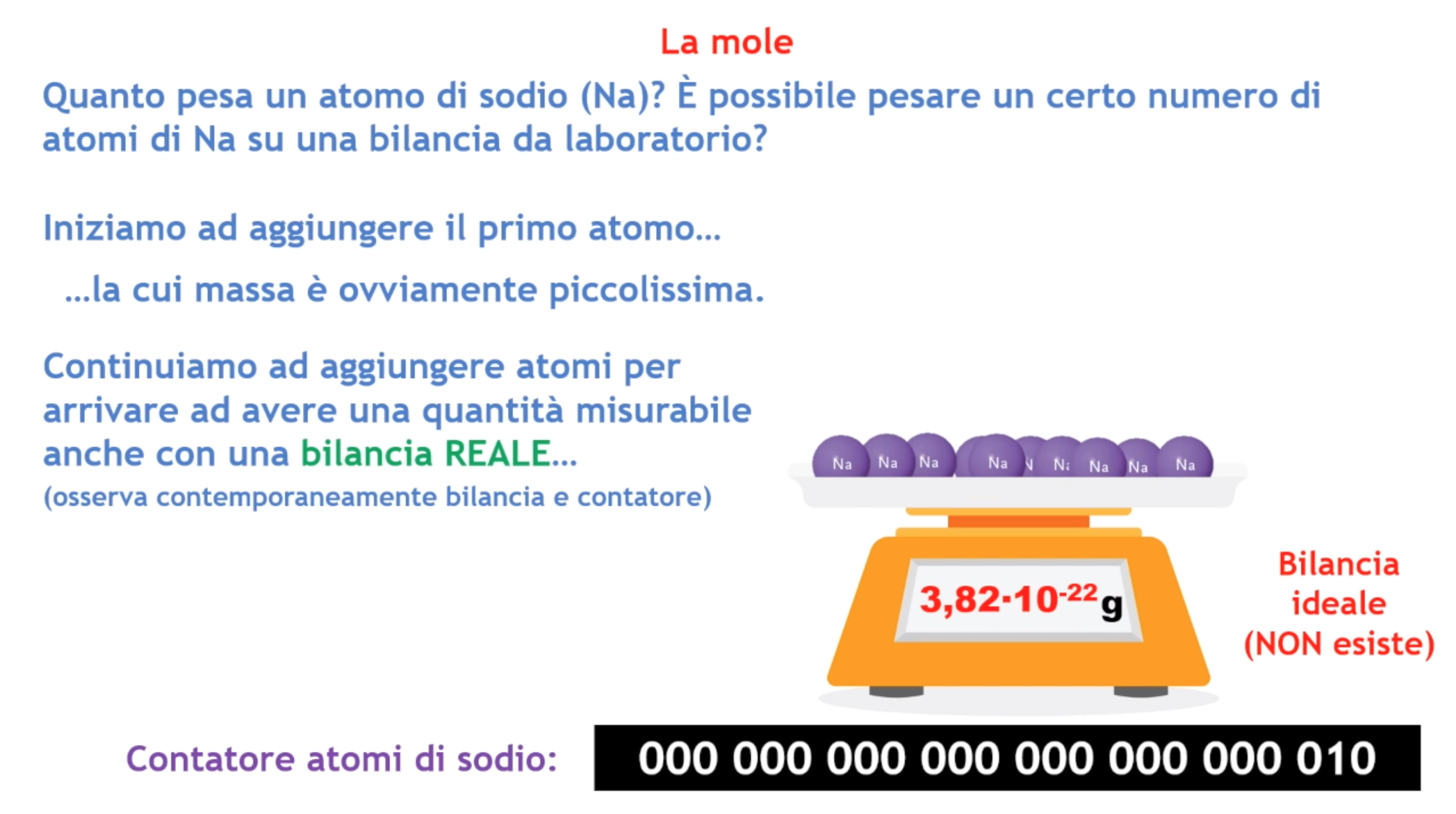

Questa rappresentazione visuale del confronto tra il peso degli atomi su una bilancia ideale e quello della bilancia reale dà più facilmente all’alunno l’idea di che cos’è la mole. È così che si riesce a far comprendere il suo vero significato: la mole è quell’unità di misura che ci consente di realizzare l’inimmaginabile, cioè ci permette di “contare” miliardi di miliardi di particelle (operazione impossibile da fare fisicamente) e dire quanto pesano!
Viceversa, se io pesassi una quantità casuale di una qualunque sostanza, grazie alla mole (e ai calcoli che stiamo per fare) potrei andare a ricavare quante particelle ci sono in quella sostanza! Una cosa fondamentale per noi chimici, soprattutto quando dobbiamo far reagire delle sostanze con delle quantità ben precise.
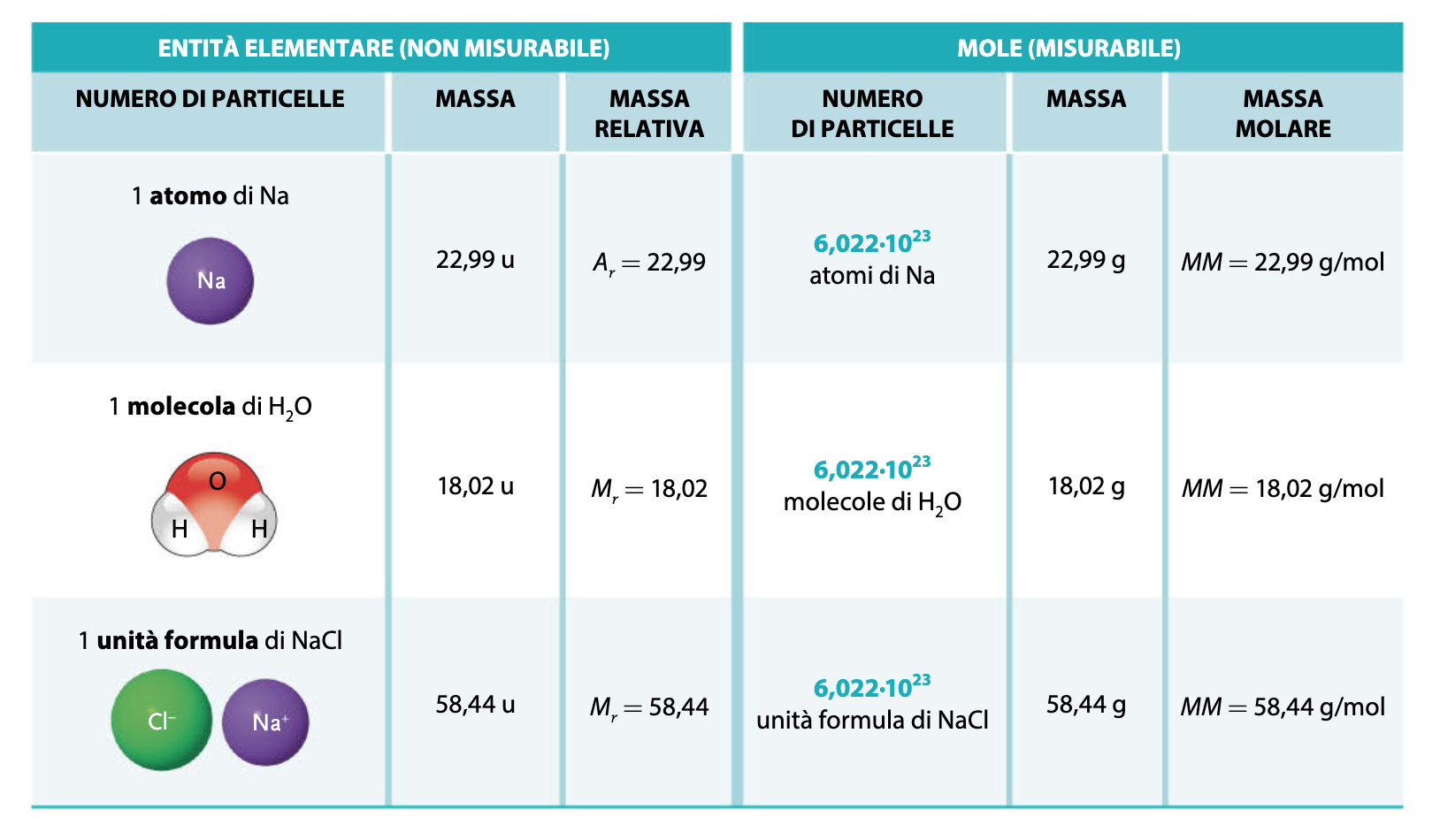
Prima di procedere con i calcoli è però necessario definire la massa molecolare relativa (ex peso molecolare), ossia un numero adimensionale ricavabile dalla tavola periodica. Successivamente, si introduce il concetto di massa molare, che corrisponde alla massa in grammi di 6,022·1023 particelle della sostanza presa in esame. È utile far notare come i numeri di queste due grandezze siano identici, cambia però l’unità di misura (da adimensionale a g/mol).
La seguente tabella riassuntiva chiarisce tutti i dubbi a riguardo: spesso si fa confusione tra la massa di una molecola (espressa in u) e la massa molecolare relativa Mr, ex peso molecolare PM (che, lo ribadiamo, non ha unità di misura).
L’applicazione pratica del concetto di mole
Siamo ora pronti a mettere in pratica quanto spiegato finora, dimostrando alla classe come si può usare la mole. Mettiamo cioè in contatto il mondo submicroscopico (impossibile da misurare fisicamente) con quello macroscopico (misurabile con le comuni bilance da laboratorio).
Il seguente schema, spiegato in dettaglio nell’ultima parte del video, mostra come è possibile partire da una massa in grammi di una sostanza e arrivare, in due passaggi, a scoprirne il numero di particelle (frecce azzurre). Ma si può fare anche l’opposto, ossia partire dal numero di particelle e ricavare la massa della sostanza (frecce viola).
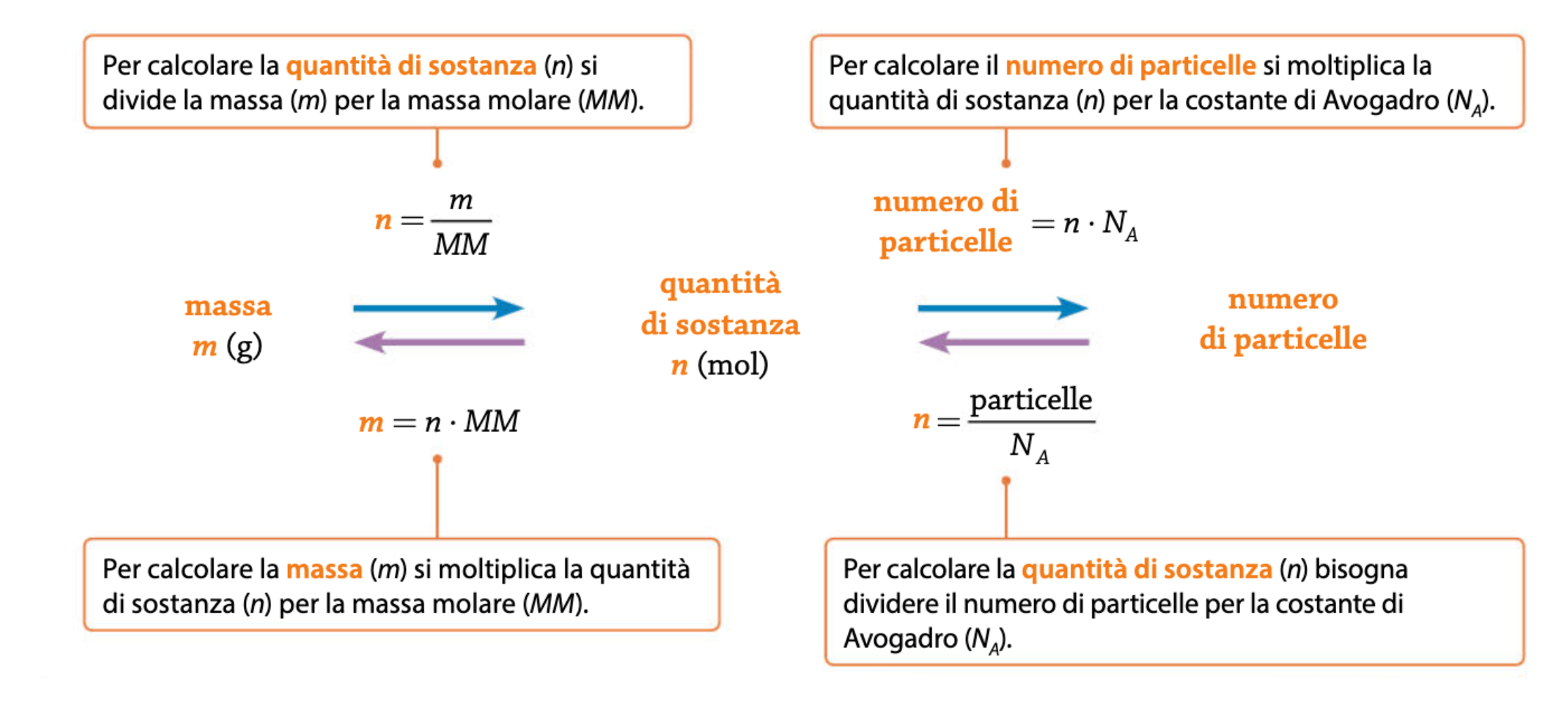
A questo punto si può fare qualche collegamento con la realtà, ad esempio facendo calcolare agli studenti la massa di una mole di zucchero (saccarosio, C12H22O11) o, al contrario, quante molecole di zucchero sono contenute in una confezione da un kilogrammo!

Ecco allora che, attraverso, queste immagini e degli esempi pratici si può rispondere alla domanda iniziale, cioè “che cos’è davvero la mole?”
La mole è un vero e proprio ponte che unisce due mondi: quello macroscopico (e misurabile sperimentalmente) e quello submicroscopico (impossibile da misurare con i comuni strumenti presenti nei nostri laboratori). E noi chimici non possiamo fare altro che ringraziarla. Thank you mole!

Quest’articolo è stato scritto il 23/10/2020, tra le 6:02 e le 18:02. Da un po’ di anni, infatti, in queste 12 ore si celebra il “mole day”. Vista la sua importanza, direi che è un riconoscimento più che meritato!
L’esperienza completa e tutte le immagini e gli schemi utilizzati sono presenti sui libri Connecting Science (Deascuola, 2019) per il primo e secondo biennio dei licei scientifici e sul nuovissimo Chimica OK (Deascuola, 2020), per il primo biennio degli istituti tecnici.
È disponibile a questo link una presentazione da usare direttamente con gli alunni, sia in aula tramite LIM, sia condividendola durante la didattica a distanza.
