
In qualsiasi essere vivente la sopravvivenza non è solo garantita dall’assunzione di sostanze nutritive ma anche dalla corretta gestione dei prodotti di scarto. Per le cellule che formano il nostro corpo vale la stessa regola: ciò che non serve più o che non funziona più deve essere eliminato. Le nostre cellule hanno tuttavia modi diversi per eliminare ciò che è malfunzionante o che non serve più, e possono variare dall’estremamente specifico al catastrofico.
Le cellule eucariotiche degradano con precisione le proteine che non assumono la corretta conformazione tridimensionale (e non sono quindi ripiegate correttamente), che non sono più utili o che non funzionano correttamente, e lo fanno in una struttura chiamata proteasoma. Questa macchina per la degradazione di proteine è una sorta di tritarifiuti che sgretola le proteine fino a renderle corti peptidi. Il proteasoma è però altamente selettivo e distrugge solamente le proteine che sono state marcate con l’ubiquitina. L’ubiquitina è un peptide di 76 aminoacidi che funziona come una sorta di etichetta. Tutte le proteine che sono ubiquitinate sono riconosciute come “spazzatura” e degradate.
La maggioranza delle proteine degradate in questo modo sono quelle che non si ripiegano correttamente dopo la sintesi lineare di aminoacidi da parte del ribosoma o in seguito a danneggiamenti di altro tipo. Una classe di proteine che invece viene degradata selettivamente nel proteasoma solo le cicline, proteine fondamentali nel ciclo replicativo della cellula, che devono essere espresse solo transitoriamente.
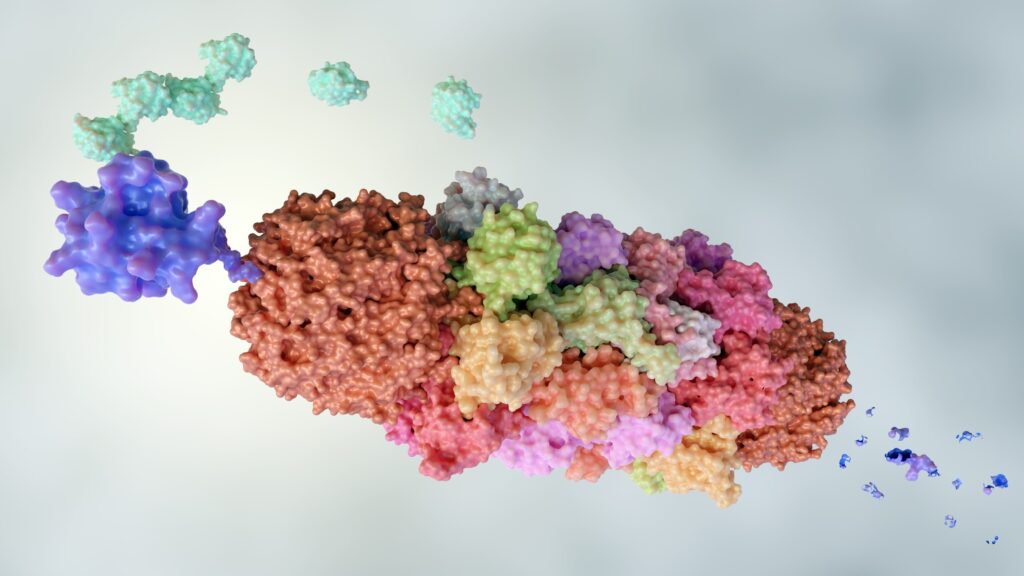
Non sempre però la degradazione delle proteine è efficiente e questo può creare malfunzionamenti cellulari. Il primo livello di allerta della cellula in questo caso è quello che viene chiamato risposta alle proteine malripiegate. La cellula ha dei sensori che vengono attivati nel caso ci siano troppe proteine non ripiegate correttamente e il proteasoma non riesca ad eliminarle. Quando questi sensori si attivano viene indotta la sintesi di proteine che aiutano le altre proteine a ripiegarsi correttamente (le proteine chaperone), viene ridotta la sintesi proteica generale per evitare ulteriori accumuli, avvengono anche cambiamenti morfologici a livello del reticolo endoplasmatico, in quanto è qui che le proteine sono sintetizzate e ripiegate, e aumenta la secrezione extracellulare di proteine
Se anche la risposta alle proteine malripiegate non è sufficiente la cellula decide di sacrificarsi per il bene della comunità, ovvero inizia il processo di morte programmata chiamato apoptosi. Questi tipi di meccanismi sono estremamente importanti nelle nostre cellule: alterazioni o assenza di degradazione di alcune proteine possono portare a problemi molto gravi per la salute.
La regolazione della degradazione proteica, anche chiamata proteostasi, è infatti coinvolta nell’invecchiamento e in alcune malattie neurodegenerative. Ad esempio l’Alzheimer è causato dall’accumulo di proteine tau e beta amiloide non ripiegate correttamente, che formano aggregati insolubili che causano morte neuronale.
L’importanza della proteostasi è stata validata anche da studi sulla popolazione umana, in cui si è visto che spesso negli ultracentenari si osserva un’alta espressione dei geni coinvolti in questi processi e dallo studio di animali modello in cui si è osservato che, inducendo l’aumento dell’espressione dei geni coinvolti nella proteostasi, si ha un aumento della durata della vita. Di conseguenza la ricerca si sta focalizzando sull’identificazione di possibili bersagli molecolari per migliorare e correggere la proteostasi.
Attività didattica
Questa attività ha lo scopo di approfondire lo studio delle fasi della mitosi e delle sue funzioni.
Scarica qui i cartoncini per svolgere l’attività in classe.
Abbina i cartoncini riportanti le fasi della mitosi ai cartoncini con le funzioni cellulari che devono essere presenti (attenzione: la lista delle funzioni non è esaustiva!). Invita le studentesse e gli studenti non solo a riflettere sulle funzioni che devono essere presenti nelle varie fasi, ma anche su quelle che devono essere arrestate (tramite ubiquitinazione delle proteine) tra una fase e l’altra.
Da questa base è poi possibile introdurre il ruolo delle cicline come direttori d’orchestra delle varie fasi e far comprendere la necessità della loro rapida degradazione tra una fase e l’altra che consente un effetto a cascata.
Qui troverai le soluzioni.
